Основные положения МКТ. Масса и размер молекул. Количество вещества. Молекулярная физика. Основные положения мкт Примеры мкт
Основные положения МКТ:
1. Все вещества состоят из мельчайших частиц: молекул, атомов или ионов.
2. Эти частицы находятся в непрерывном хаотическом движении, скорость которого определяет температуру вещества.
3. Между частицами существуют силы притяжения и отталкивания, характер которых зависит от расстояния между ними.
Идеальный газ - это газ, взаимодействие между молекулами которого пренебрежимо мало.
Основные отличия идеального газа от реального: частицы идеального газа - шарики очень малых размеров, практически материальные точки; между частицами отсутствуют силы межмолекулярного взаимодействия; соударения частиц абсолютно упругие. Реальный газ - газ, который не описывается уравнением состояния идеального газа Клапейрона - Менделеева. Зависимости между его параметрами показывают, что молекулы в реальном газе взаимодействуют между собой и занимают определенный объем. Состояние реального газа часто на практике описывается обобщенным уравнением Менделеева - Клапейрона.
2 Параметры и функции состояния. Уравнение состояния идеального газа.
Параметры:
Давление обусловлено взаимодействием молекул рабочего тела с поверхностью и численно равно силе, действующей на единицу площади поверхности тела по нормали к последней.
Температурой называется физическая величина, характеризующая степень нагретости тела. С точки зрения молекулярно-кинетических представлений температура есть мера интенсивности теплового движения молекул.
Удельный объем v - это объем единицы массы вещества. Если однородное тело массой М занимает объем v, то по определению v= V/М. В системе СИ единица удельного объема 1 м3/кг. Между удельным объемом вещества и его плотность существует очевидное соотношение:
Если все термодинамические параметры постоянны во времени и одинаковы во всех точках системы, то такое состояние системы называется равновесным.
Для равновесной термодинамической системы существует функциональная связь между параметрами состояния, которая называется уравнением состояния
уравнение Клапейрона - Менделеева
3 Смеси газов. Кажущаяся молекулярная масса. Газовая постоянная смеси газов.
Смесь газов – механическое соединение не вступающих друг с другом химическую реакцию газов. Основным законом, определяющим поведение газовой смеси, является закон Дальтона: полное давление смеси идеальных газов равно сумме парциальных давлений всех входящих в нее компонентов:Парциальное давление pi - давление, которое имел бы газ, если бы он один при той же температуре занимал весь объем смеси. Газовую постоянную смеси определяют как:,- кажущаяся (средняя) молекулярная масса смеси. При объемном составе, при массовом составе:.-универсальная газовая постоянная.
4 Первый закон термодинамики.
Первый закон термодинамики - это закон сохранения энергии, записанный с помощью термодинамических понятий (аналитическая формулировка: вечный двигатель 1 рода невозможен):
Энергия. Под внутренней энергией в термодинамике понимают кинетическую энергию движения молекул, потенциальную энергию их взаимодействия и нулевая (энергея движения частиц внутри молекулы при T=0K). Кинетическая энергия молекул является функцией температуры, значение потенциальной энергии зависит от среднего расстояния между молекулами и, следовательно, от занимаемого газом объема V, т. е. является функцией V. Поэтому внутренняя энергия U есть функция состояния тела.
Теплота. Энергия, предаваемая от одного тела к другому за счет разности температур, называется теплотой. Теплота может передаваться либо при непосредственном контакте между телами (теплопроводностью, конвекцией), либо на расстоянии (излучением), причем во всех случаях этот процесс возможен только при наличии разности температур между телами.
Работа. Энергия, передаваемая от одного тела к другому при изменении объема этих тел или перемещение в пространстве, называется работой. При конечном изменении объема работа против сил внешнего давления, называемая работой расширения, равна Работа изменения объема эквивалентна площади под кривой процесса в диаграмме р, v.
Внутренняя энергия - это свойство самой системы, она характеризует состояние системы. Теплота и работа - это энергетические характеристики процессов механического и теплового взаимодействий системы с окружающей средой. Они характеризуют те количества энергии, которые переданы системе или отданы ею через ее границы в определенном процессе.
§ 2. Молекулярная физика. Термодинамика
Основные положения молекулярно-кинетической теории (МКТ) заключаются в следующем.1. Вещества состоят из атомов и молекул.
2. Атомы и молекулы находятся в непрерывном хаотическом движении.
3. Атомы и молекулы взаимодействуют между собой с силами притяжения и отталкивания
Характер движения и взаимодействия молекул может быть разным, в связи с этим принято различать 3 агрегатных состояния вещества: твёрдое, жидкое и газообразное . Наиболее сильно взаимодействие между молекулами в твёрдых телах. В них молекулы расположены в так называемых узлах кристаллической решётки, т.е. в положениях, при которых равны силы притяжения и отталкивания между молекулами. Движение молекул в твёрдых телах сводится к колебательному около этих положений равновесия. В жидкостях ситуация отличается тем, что, поколебавшись около каких-то положений равновесия, молекулы часто их меняют. В газах молекулы далеки друг от друга, поэтому силы взаимодействия между ними очень малы и молекулы движутся поступательно, изредка сталкиваясь между собой и со стенками сосуда, в котором они находятся.
Относительной молекулярной массой M r называют отношение массы m o молекулы к 1/12 массы атома углерода m oc:
Количество вещества в молекулярной физике принято измерять в молях.
Молем ν
называется количество вещества, в котором содержится столько же атомов или молекул (структурных единиц), сколько их содержится в 12 г углерода. Это число атомов в 12 г углерода называется числом Авогадро
:
Молярная масса M = M r · 10 −3 кг/моль
- это масса одного моля вещества. Количество молей в веществе можно рассчитать по формуле
Основное уравнение молекулярно-кинетической теории идеального газа:
где m 0
- масса молекулы; n
- концентрация молекул; Ṽ
- средняя квадратичная скорость движения молекул.
2.1. Газовые законы
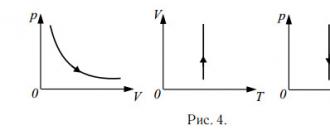
Уравнение состояния идеального газа - уравнение Менделеева-Клапейрона:Изотермический процесс (закон Бойля-Мариотта):
Для данной массы газа при неизменной температуре произведение давления на его объём есть величина постоянная:
В координатах p − V
изотерма - гипербола, а в координатах V − T
и p − T
- прямые (см. рис. 4)
Изохорный процесс
(закон Шарля):
Для данной массы газа при неизменном объёме отношение давления к температуре в градусах Кельвина есть величина постоянная
(см. рис. 5).
Изобарный процесс
(закон Гей-Люссака):
Для данной массы газа при неизменном давлении отношение объёма газа к температуре в градусах Кельвина есть величина постоянная
(см. рис. 6).
Закон Дальтона
:
Если в сосуде находится смесь нескольких газов, то давление смеси равно сумме парциальных давлений, т.е. тех давлений, которые каждый газ создавал бы в отсутствии остальных.
2.2. Элементы термодинамики
Внутренняя энергия тела равна сумме кинетических энергий беспорядочного движения всех молекул относительно центра масс тела и потенциальных энергий взаимодействия всех молекул друг с другом.Внутренняя энергия идеального газа представляет собой сумму кинетических энергий беспорядочного движения его молекул; так как молекулы идеального газа не взаимодействуют друг с другом, то их потенциальная энергия обращается в нуль.
Для идеального одноатомного газа внутренняя энергия

Количеством теплоты Q называют количественную меру изменения внутренней энергии при теплообмене без совершения работы.
Удельная теплоёмкость - это количество теплоты, которое получает или отдаёт 1 кг вещества при изменении его температуры на 1 К
Работа в термодинамике:
работа при изобарном расширении газа равна произведению давления газа на изменение его объёма:
Закон сохранения энергии в тепловых процессах (первый закон
термодинамики):
изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе:
Применение первого закона термодинамики к изопроцессам:
а)
изотермический процесс T = const ⇒ ∆T = 0.
В этом случае изменение внутренней энергии идеального газа
Следовательно: Q = A.
Всё переданное газу тепло расходуется на совершение им работы против внешних сил;
б)
изохорный процесс V = const ⇒ ∆V = 0.
В этом случае работа газа
Следовательно, ∆U = Q.
Всё переданное газу тепло расходуется на увеличение его внутренней энергии;
в)
изобарный процесс p = const ⇒ ∆p = 0.
В этом случае:
Адиабатным
называется процесс, происходящий без теплообмена с окружающей средой:
В этом случае A = −∆U
, т.е. изменение внутренней энергии газа происходит за счёт совершения работы газа над внешними телами.
При расширении газ совершает положительную работу. Работа A, совершаемая внешними телами над газом, отличается от работы газа только знаком:
Количество теплоты, необходимое для нагревания тела
в твёрдом или жидком состоянии в пределах одного агрегатного состояния, рассчитывается по формуле
где c - удельная теплоёмкость тела, m - масса тела, t 1 - начальная температура, t 2 - конечная температура.
Количество теплоты, необходимое для плавления тела
при температуре плавления, рассчитывается по формуле
где λ - удельная теплота плавления, m - масса тела.
Количество теплоты, необходимое для испарения
, рассчитывается по формуле
где r - удельная теплота парообразования, m - масса тела.
Для того чтобы превратить часть этой энергии в механическую, чаще всего пользуются тепловыми двигателями. Коэффициентом полезного действия теплового двигателя
называют отношение работы A, совершаемой двигателем, к количеству теплоты, полученному от нагревателя:
Французский инженер С. Карно придумал идеальную тепловую машину с идеальным газом в качестве рабочего тела. КПД такой машины
В воздухе, представляющем из себя смесь газов, наряду с другими газами находятся водяные пары. Их содержание принято характеризовать термином «влажность». Различают абсолютную и относительную влажность.
Абсолютной влажностью
называют плотность водяных паров в воздухе - ρ ([ρ] = г/м 3).
Можно характеризовать абсолютную влажность парциальным давлением водяных паров - p
([p] = мм. рт. столба; Па).
Относительная влажность (ϕ)
- отношение плотности водяного пара, имеющегося в воздухе, к плотности того водяного пара, который должен был бы содержаться в воздухе при этой температуре, чтобы пар был насыщенным. Можно измерять относительную влажность как отношение парциального давления водяного пара (p) к тому парциальному давлению (p 0), которое имеет насыщенный пар при этой температуре:
ОПРЕДЕЛЕНИЕ
Атом — наименьшая частица данного химического элемента. Все существующие в природе атомы представлены в периодической системе элементов Менделеева.
Атомы соединяются в молекулу за счет химических связей, основанных на электрическом взаимодействии. Число атомов в молекуле может быть разным. Молекула может состоять из одного, из двух, трех и даже нескольких сотен атомов.
ОПРЕДЕЛЕНИЕ
Молекула - наименьшая частица данного вещества, обладающая его химическими свойствами.
Молекулярно-кинетическая теория - учение о строении и свойствах вещества на основе представлений о существовании атомов и молекул.
Основоположником молекулярно-кинетической теории является М.В. Ломоносов (1711-1765), который сформулировал ее основные положения и применил их к объяснению различных тепловых явлений.
Основные положения молекулярно-кинетической теории
Основные положения МКТ:
- все тела в природе состоят из мельчайших частиц (атомов и молекул);
- частицы находятся в непрерывном хаотическом движении, которое называется тепловым;
- частицы взаимодействуют друг с другом: между частицами действуют силы притяжения и отталкивания, которые зависят от расстояния между частицами.
Молекулярно-кинетическая теория подтверждается многими явлениями.
Смешивание различных жидкостей, растворение твердых тел в жидкостях объясняется перемешиванием молекул различного рода. При этом объем смеси может отличаться от суммарного объема входящих в нее компонент. что говорит о разных размерах молекулярных соединений.
ОПРЕДЕЛЕНИЕ
Диффузия - явление проникновения двух или нескольких соприкасающихся веществ друг в друга.
Наиболее интенсивно диффузия протекает в газах. Распространение запахов обусловлено диффузией. Диффузия свидетельствует о том, что молекулы находятся в постоянном хаотическом движении. Также явление диффузии свидетельствует о том, что между молекулами есть промежутки, т.е. вещество является дискретным.
ОПРЕДЕЛЕНИЕ
Броуновское движение - тепловое движение мельчайших микроскопических частиц, взвешенных в жидкости или газе.
Это явление впервые наблюдал английский ботаник Р. Броун в 1827 г. Наблюдая в микроскоп цветочную пыльцу, взвешенную в воде, он увидел, что каждая частица пыльцы совершает быстрые беспорядочные движения, перемещаясь на некоторое расстояние. В результате отдельных перемещений каждая частица пыльцы двигалась по зигзагообразной траектории (рис. 1, а).
Рис.1. Броуновское движение: а) траектории движения отдельных частиц, взвешенных в жидкости; б) передача импульса молекулами жидкости взвешенной частице.
Дальнейшие исследования броуновского движения в различных жидкостях и с различными твердыми частицами показали, что это движение становится тем интенсивнее, чем меньше размеры частиц и чем выше температура опыта. Это движение никогда не прекращается и не зависит от каких-либо внешних причин.
Р. Броун не смог дать объяснение наблюдаемому явлению. Теория броуновского движения была построена А. Эйнштейном в 1905 г. и получила экспериментальное подтверждение в опытах французского физика Ж. Перрена (1900-1911 гг.).
Молекулы жидкости, которые находятся в постоянном хаотическом движении при столкновении со взвешенной частицей передают ей некоторый импульс (рис.1, б). В случае частицы больших размеров число налетающих на нее со всех сторон молекул велико, их удары в каждый момент времени компенсируются, и частица остается практически неподвижной. Если же размер частицы очень мал, то удары молекул не компенсируются - с одной стороны об нее может удариться большее число молекул, чем с другой, в результате чего частица придет в движение. Именно такое движение под влиянием беспорядочных ударов молекул и совершают броуновские частицы. Хотя броуновские частицы по массе в миллиарды раз превосходят массу отдельных молекул и движутся с очень малыми скоростями (по сравнению со скоростями молекул), все же их движение можно наблюдать в микроскоп.
Примеры решения задач
ПРИМЕР 1
ПРИМЕР 2
Что такое молекулярно-кинетическая теория
Определение
Молекулярно-кинетическая теория (МКТ) -- раздел молекулярной физики, который стоится на изучении свойств вещества основываясь на их внутреннем молекулярном строении.
Основной постулат МКТ: вещество состоит из молекул, которые непрерывно хаотично движутся и взаимодействуют между собой по определенным законам. Движение молекул воспринимается как тепловое. Многие явления, происходящие в газах, жидкостях или твердых телах находят объяснения с точки зрения МКТ. Так, например, давление производимое газом на стенки сосуда объясняется как результат многочисленных соударений молекул газа на стенки сосуда. При этом молекулы передают стенкам свой импульс. Усредненная кинетическая энергия частиц определяет такой макропараметр как температура.
МКТ и статистическая физика
Молекулярно-кинетическая теория целиком опирается на статистические методы. Поэтому она часто именуется статистической физикой.
Определение
Статистической физикой называют раздел физики, в котором изучают макроскопические свойства систем, состоящих из очень большого числа частиц (молекул, атомов, электронов), через свойства этих частиц и взаимодействие между ними.
Статистическая физика рассматривает системы, находящиеся в равновесном состоянии (равновесная статистическая физика) и неравновесных состояниях физическая кинетика.
Как строится такая физика? В отличие от термодинамики она исходит не из общих принципов, а из модели молекулярного строения рассматриваемого объекта. Опираясь на механику (атомы рассматриваются как механические системы) и статистику она выводит затем те или иные термодинамические закономерности. Главное ее достоинство - большая глубина объяснений, наблюдаемых свойств и явлений. Чистая ("феноменологическая") термодинамика описывает внутренние свойства тел, не анализируя их строения. В чистой термодинамике, например, отсутствует понятие атома. Статистическая физика, наоборот, начинает изучение явлений с описания строения тел. Она, может быть, не занимается подробным описанием атомов, однако атомы, их движение, их взаимодействие являются основными понятиями статистической физики, на которых строится модель. Эта модель в той или иной мере упрощает, что ведет к ограниченности выводов, получаемых на ее основе.
Статистические закономерности
Поведение систем, состоящих из большого числа частиц, определяется статистическими закономерностями, которые существенно отличаются от законов механики. Поведение отдельных частиц, входящих в систему, например, траектория частицы, при статистическом описании системы оказывается несущественным. Поэтому изучение свойств системы сводится к отысканию средних значений физических величин, характеризующих состояние системы как целого. Существенное отличие систем, которые подчиняются статистическим законам, состоит в том, что поведение и свойства в значительной степени не зависят от их начального состояния.
Связь между динамическими закономерностями (описывающими движения отдельных частиц) и статистическим закономерностями проявляется в том, что свойства макроскопической системы определяется законами движения отдельных частиц.
В статистической физике используют эргодическую гипотезу. Согласно этой гипотезе предполагается, что в термодинамически равновесной системе средние по времени значения физических величин, характеризующие систему равны их средним статистическим значениям, то есть средним статистическим по равномерному распределению фазовых точек в тонком слое энергии, рассчитанным в один и тот же произвольный момент времени.
В классической статистической физике считается, что в термодинамически равновесной системе действует закон равномерного распределения энергии:
на каждую степень свободы частицы, образующих систему, в среднем, приходится одинаковая кинетическая энергия, равная:
где $i$- число степеней свободы молекулы, k- постоянная Больцмана, Т - термодинамическая температура.
При колебательном движении частица имеет как кинетическую, так и потенциальную энергию. Если колебания гармонические, то кинетическая и потенциальная энергии равны в среднем друг другу. Поэтому на одну колебательную степень свободы приходится в среднем энергия равная:
Пример 1
В качестве одного из примеров применения молекулярно-кинетической теории можно рассмотреть вывод выражения для давления газа.
Рассмотрим давление идеального газа в состоянии равновесия.
Давление определяется силой $\triangle F$, с которой газ давит на единицу площади $\triangle S$ стенки сосуда:
Сила есть импульс, передаваемый от тела к телу в секунду:
\[\triangle \overrightarrow{F}=\frac{\triangle \overrightarrow{p}}{\triangle t}(1.2)\]
Значит, чтобы найти давление газа, нужно найти, какой импульс передаёт газ единице площади стенки сосуда в секунду. Займемся этим расчётом. Будем считать, что соударение отдельной молекулы со стенкой сосуда подчиняется законам упругого столкновения: молекула отскакивает от стенки с первоначальным по модулю импульсом и угол ее падения равен углу отражения (рис. 1).
В этом случае от молекулы стенке передаётся только х - составляющая импульса:
\[\triangle p_x=mv_x-\left(-mv_x\right)=2mv_x\ (1.3)\]
Движение молекул в направлении других осей координат при передаче импульса выбранной стенке не существенно, и можно считать, что молекулы движутся только по оси х. (Движение по другим осям будет учтено в конце расчёта.) Найдем число столкновений молекул о площадку с единичной площадью стенки в секунду, если скорость молекулы равна $v_x$. Легко понять, что это число pавно числу молекул с данной скоростью, находящихся в цилиндре с основанием в единицу площади и высотой, численно равной $v_x$.(рис. 2) В самом деле, молекулы вне данного цилиндpа пpосто не попадут в течение секунды на заданную единицу площади стенки (или не долетят до стенки, или ударятся о стенку не в том месте).

Наоборот, все молекулы, попадающие в цилиндр, проходя за секунду путь, равный $v_x$, попадут на данную площадь стенки сосуда. Обозначим число молекул, обладающих заданной скоростью $v_x$ и находящихся в единице объема газа, через $n_{vx}$ Тогда число молекул, попадающих в цилиндp, или число молекул, удаpяющихся о стенку со скоpостью $v_x$ равно: $v_xn_{vx}$.
Эти молекулы передают стенке импульс, равный:
\[{2mv_xv_xn}_{vx}=2mv^2_xn_{vx}\left(1.4\right)\]
Полный же импульс, который получает стенка на единице площади, т.е. давление газа, определяется суммированием таких выражений по всем возможным положительным значениям скорости молекулы:
Обозначим через n полное число молекул в единице объема газа. Половина из них летит к стенке (имеет скорость $v_x>0$). Перепишем формулу (1.5) в виде:
и учтем, что выражение $\frac{\sum\limits_{v_x>0}{v^2_xn_{vx}}}{\frac{n}{2}}$представляет собой средний квадрат скорости молекулы. Средние величины будем обозначать скобками $$. Следовательно, формулу (1.6) можно переписать так:
Наконец, учтем, что скоpости молекул газа pаспpеделены по напpавлениям pавномеpно (газ изотpопен), и, следовательно,
\[ =++=3 (1.8)\]
Поэтому окончательно формулу для давления газа представим в виде:
Итак, давление идеального газа в состоянии равновесия равно двум третям произведения средней кинетической энергии поступательного движения молекулы газа на число молекул в единице объема газа.
Пример 2
Задание: Кислород находится в сосуде при T=300K. Определить среднюю энергию вращательного движения молекул.
Решение: Кислород имеет в молекуле 2 атома, следовательно у него 2 вращательные степени свободы, для вычисления энергии используем формулу (2.1) при i=2:
\[=\frac{i}{2}kT=kT(2.1)\]
Проведем вычисления:
\[ Ответ: Средняя энергия вращательного движения молекул кислорода равна $4,14\cdot 10^{-21}Дж$.
Вещество состоит из частиц.
Молекула - это самая маленькая частица вещества, которая обладает его основными химическими свойствами.
Молекула состоит из атомов. Атом - наименьшая частица вещества, которая не делится при химических реакциях.
Многие молекулы состоят из двух или больше атомов, удерживаемых вместе химическими связями. Некоторые молекулы состоят из сотен тысяч атомов.
Второе положение молекулярно-кинетической теории
Молекулы находятся в непрерывном хаотическом движении. Это движение не зависит от внешних воздействий. Движение происходит в непредсказуемом направлении из-за столкновения молекул. Доказательством является броуновское движение частиц (открыто Р.Броуном 1827г). Частицы помещают в жидкость или газ и наблюдают их непредсказуемое движение из-за соударений с молекулами вещества.

Броуновское движение
Доказательством хаотического движения является диффузия - проникновение молекул одного вещества в промежутки между молекулами другого вещества. Например, запах освежителя воздуха мы ощущаем не только в том месте, где его распылили, но он постепенно перемешивается с молекулами воздуха во всей комнате.
Агрегатное состояние вещества
В газах среднее расстояние между молекулами в сотни раз превышает их размеры. В основном молекулы движутся поступательно и равномерно . После столкновений начинают вращаться.
В жидкостях расстояние между молекулами значительно меньше. Молекулы совершают колебательное и поступательное движения. Молекулы через малые промежутки времени скачкообразно переходят в новые положения равновесия (мы наблюдаем текучесть жидкости).
В твердых телах молекулы колеблются и очень редко перемещаются (только при увеличении температуры).
Третье положение молекулярно-кинетической теории
Между молекулами существуют силы взаимодействия, которые имеют электромагнитную природу . Эти силы позволяют объяснить возникновение сил упругости . Когда вещество сжимают, молекулы сближаются, между ними возникает сила отталкивания, когда внешние силы отдаляют молекулы друг от друга (растягивают вещество), между ними возникает сила притяжения.
Плотность вещества
Это скалярная величина, которая определяется по формуле


Плотность веществ - известные табличные значения
Химические характеристики вещества
Постоянная Авогадро N A - число атомов, содержащихся в 12г изотопа углерода